
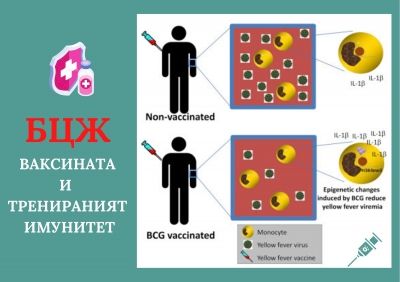
БЦЖ ваксинацията предпазва от експериментална вирусна инфекция при хора чрез индукция на цитокини, свързани с трениран имунитет
Туберкулозната ваксина Ваcillus Calmette-Guеrin (BCG) има хетероложни благоприятни ефекти срещу не-свързани инфекции. Основата на тези ефекти е слабо проучена при хората. В рандомизирано плацебо-контролирано изследване се открива, че BCG ваксинацията индуцира широко геномно епигенетично препрограмиране на моноцити и се предпазва от експериментална инфекция с атенюиран щам на ваксина срещу вируса на жълтата треска. Епигенетичното препрограмиране е било придружено от функционални промени, показателни за тренирания имунитет. Намаляването на виремията е силно свързано с увеличаването на IL-1β, хетеролозен цитокин, свързан с индуцирането на трениран имунитет, но не и със специфичния IFNγ отговор. Значението на IL-1β за индуциране на тренирания имунитет е потвърдено чрез генетични, епигенетични и имунологични изследвания. В заключение, BCG индуцира епигенетично препрограмиране в човешки моноцити in vivo, последвано от функционално препрограмиране и защита срещу несвързани вирусни инфекции, с ключова роля за IL-1β като медиатор на реакциите на имунитета.
Кратка история на БЦЖ ваксината в България
България е втората страна в света след Япония, въвела задължително БЦЖ ваксиниране – 1951 година – като от българския опит днес се възползват повече от 180 държави. От 1991 година българската лаборатория е една от трите лаборатирии в света, които биват одобрени от Световната здравна организация (СЗО) за доставчик на УНИЦЕФ.
Създателката на българската БЦЖ ваксина се казва д-р Сребра Родопска. Тя е родена на 17 април 1913 година в София. След като малкото й братче почива от заушка, д-р Родопска решава да се насочи към медицината. След завършване на висшето си образование, тя постъпва на работа в настоящия Научноизследователски институт по епидемиология.
През 1948 година заминава за Париж заедно със съпруга си – проф. Ташо Ташев, специалист по вътрешни болести. В продължение на година специализира в института „Пастьор“, където създава живата френска ваксина срещу туберкулоза. Тя я пренася в България и я адаптира, използвайки руски ваксинален субщам – 374А.
Д-р Родопска получава признание от световната научна общност по време на първата техническа конференция в Женева през 1956 година.
Тя живее до 93 годишна възраст, а резултатите от нейната научна дейност са запазили здравето и живота на милиони по цял свят.
През 2020 г. големият въпрос, кацаещ БЦЖ ваксината, е помага ли тя срещу пандемията Ковид-19? Задъжителното ваксиниране ли пощади България от по-мащабно разпространение на на новия коронавирус в страната? Предпазва ли от заразяване БЦЖ-инирането като завишава нашия имунитет? Въпроси, на които до този момент няма отговор, а само предположения.
Новини:
Популярно в момента:
Предпазна маска за лице FFP2 NR
Въведение - БЦЖ
Bacillus Calmette-Guеrin (BCG) е жив атенюиран ваксинен щам на Mycobacterium bovis, който предпазва от микобактериални инфекции като туберкулоза и проказа, и към днешна дата се използва от почти век (Colditz et al., 1994, Zumla et al., 2013 ). Интересното е, че БЦЖ ваксината има и хетероложни защитни ефекти срещу несвързани инфекции: няколко епидемиологични проучвания показват, че ваксинацията при раждане води до намалена детска смъртност (Hirve et al., 2012, Kristensen et al., 2000, Moulton et al., 2005, Roth et al., 2005). Тези благоприятни ефекти на БЦЖ са валидирани в рандомизирани контролирани проучвания и намалената смъртност изглежда се дължи главно на защита срещу неонатален сепсис и респираторни инфекции (Aaby et al., 2011, Biering-Sшrensen et al., 2012, Roth et al. ., 2004). Показано е също, че ваксинацията с БЦЖ защитава от смъртност при експериментални модели на немикобактериални инфекции при мишки (обобщени в Blok et al., 2015). И накрая, БЦЖ се използва като неспецифична имунотерапия при рак, като БЦЖ инсталациите при рак на пикочния мехур предизвикват имуностимулиращи ефекти, които забавят прогресията на тумора (Han and Pan, 2006).
Предложени са два вида имунологични механизми за посредничество на тези ефекти. Първо, клетките на CD4 и CD8 паметта могат да бъдат активирани по независим от антиген начин (например от цитокини, стимулирани от вторична инфекция), процес наречен хетеролозен имунитет (Berg et al., 2002, Berg et al., 2003, Lertmemongkolchai et al., 2001, Mathurin et al., 2009). Второ, БЦЖ ваксинацията предизвиква хистонови модификации и епигенетично препрограмиране на човешки моноцити в промоторните сайтове на гени, кодиращи възпалителни цитокини като TNFA и IL6, което води до по-активен вроден имунен отговор след рестимулация, процес, наречен трениран имунитет (Kleinnijenhuis et al. , 2012, Netea et al., 2016). Въпреки това, степента на ефектите на BCG върху модификациите на хистон на ниво на генома остава неизвестна. Освен това, докато описаните епидемиологични проучвания ясно предполагат защитни хетероложни ефекти на BCG, контролирани експериментални проучвания при хора за установяване на имунологичната основа за тези наблюдения остават изключителни и потенциалната роля на тренирания имунитет при посредничеството на тези ефекти не е оценена.
В едно от последните проучвания са изследвани ефектите на ваксинацията с БЦЖ върху модификациите на хистона в целия геном, индуцирани в циркулиращите моноцити чрез БЦЖ ваксинация. Впоследствие се разглеждат функционалните промени, предизвикани от БЦЖ в моноцити, и проучени как BCG ваксинацията влияе върху вирусни, серологични и имунологични параметри след прилагане на ваксина срещу жълта треска (YFV). YFV е атенюиран вирусен щам, който може да бъде открит в кръвообращението след ваксинация, като по този начин е идеален модел за експериментална вирусна инфекция при хора. Ние показваме, че БЦЖ ваксинацията намалява нивото на YFV виремия след ваксинация и че този ефект корелира с индуцирането на цитокинните отговори, показателни за тренирания имунитет, с решаваща роля за производството и освобождаването на IL-1β.
Свързани статии:
Резултати от БЦЖ проучването
БЦЖ ваксинацията предизвиква епигенетично препрограмиране на човешки моноцити в генома in vivo. In vitro експериментите по-рано показват, че повишените цитокинови отговори след моноцитно обучение с БЦЖ са резултат от епигенетични промени (Arts et al., 2015). За да се изследва геномното свързване на епигенетичната програма с БЦЖ, моноцитите от седем донора са анализирани чрез хроматиново имунопреципитационно секвениране (ChIP-seq) за определяне на промените в генома в разпределението на хистон Н3 ацетилиране при лизин 27 (H3K27ac), маркер за активни промотори и подобрители, на "изходно ниво" (преди BCG ваксинация, ден 28) и "BCG 1 месец" (1 месец след ваксинацията с BCG, ден 0). Корелационните участъци на четене на последователност на целия геном на H3K27ac показват ясно разделяне на изходните проби и BCG, особено когато анализът беше ограничен до пикове, които са силно индуцирани (> 3 SD) при поне един донор или със статистически значима промяна на най-малко 1,5 (фигури 1А и S1A). Топлинната карта ясно показва разделянето на пробите от изходните стойности и след BCG според 646 диференциални пикове H3K27ac (Фигура 1В). Подобен ефект е наблюдаван, когато анализът е ограничен до пикове, свързани с промоторите (фигури S1B и S1C). Накрая, анализът на пътя, включващ гени в близост до 646 диференциални пикове, показва диференциална регулация на няколко важни сигнално-възпалителни пътища (Фигура 1С; Таблици S2 и S3).
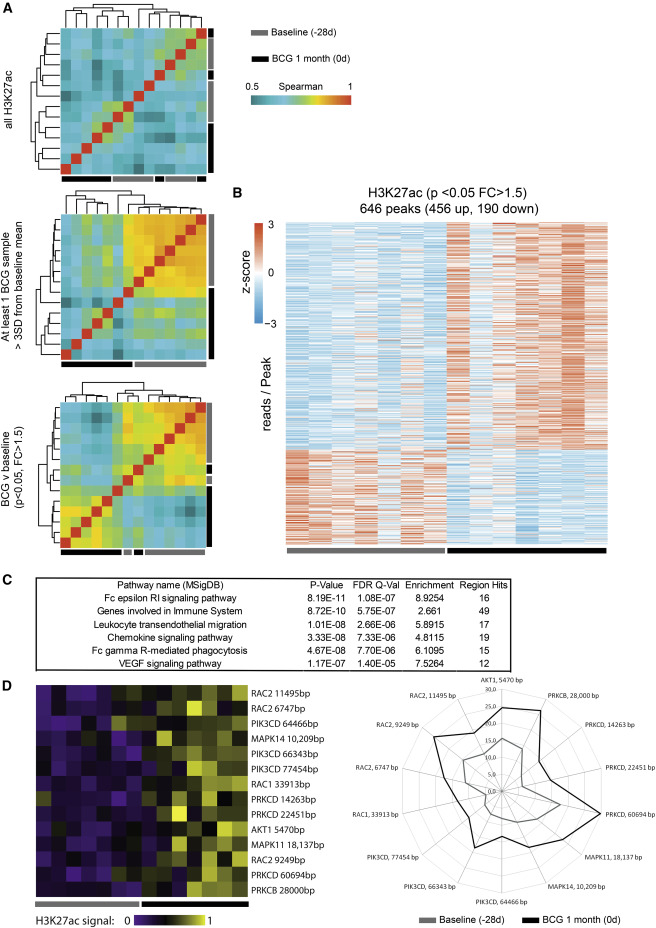
Фигура 1: BCG индуцирана от ваксинация промяна в генома H3K27ac в моноцитите
Повечето промени, предизвикани от BCG ваксинация в промоторни региони, включват рецептори, свързани с G протеин и протеин кинази, което показва екстензивния ефект на BCG върху ремоделиране на сигнални трансдукционни молекули (Таблица S3). Съответно, BCG индуцира повишен H3K27ac в няколко важни сигнални пътя, включително PI3K / AKT (фосфатидилининозитол 3-киназа), рецептор на епидермален растежен фактор (EGFR), фактор на растежен фибробласт (FGF) и сигнални пътища на съдовия ендотелен фактор (VEGF) (Таблица S3) (урегулирани гени, участващи в тези пътища, могат да бъдат намерени в таблица S4). Интересното е, че гени като AKT1, MAPKs и PI3K-свързани гени, за които е доказано, че са основни регулатори в обучения на β-глюкан трениран имунитет, изглежда са важни и при обучения от BCG трениран имунитет (Cheng et al., 2014, Saeed et al., 2014) (Фигура 1D; Таблица S4). Гените, пряко участващи във възпалителния отговор и производството на цитокини, също показват повишен H3K27ac след BCG ваксинация. Интригуващо, рецепторът на окислен липопротеин с ниска плътност (oxLDL), OLR1, маркер за атеросклероза, показан преди това, че индуцира дългосрочен провъзпалителен фенотип в моноцитите (Bekkering et al., 2014), също е диференцирано регулиран при BCG ваксинация (Таблица S3).
РНК секвенирането също е проведено върху същите проби, но както се очаква и както е показано преди (Novakovic et al., 2016, Saeed et al., 2014), не са открити големи разлики. Това показва, че тренираните моноцити са епигенетично грундирани, за да реагират (транскрипционно) по различен начин на вторичен стимул (например ex vivo стимулация), но че в състояние на покой те не показват променена транскрипционна програма.
Епигенетичното препрограмиране се придружава от БЦЖ-индуцирани функционални промени
В съответствие с предишни открития на БЦЖ-индуцирани функционални промени в моноцитите (Arts et al., 2016, Cheng et al., 2016), се демонстрира, че гените, участващи в пътя на PI3K / AKT / mTOR, вече са маркирани на епигенетично ниво. Този път има решаваща роля за увеличения капацитет за производство на цитокини по време на индуциране на трениран имунитет (Arts et al., 2016, Cheng et al., 2016) и тези епигенетични промени при БЦЖ ваксинацията наистина са придружени от засилени ex vivo отговори на цитокини към несвързани патогени, както се вижда от увеличения капацитет за производство на цитокини 1 месец след БЦЖ ваксинация (фигури 2A, 2B и S2), което не е резултат от разликите в субпопулациите на моноцитите или общия брой на моноцитите (Фигура S3A). Хетерологичните Т клетъчни отговори са умерено повишени след БЦЖ ваксинация (Фигура S2). Индукцията на производство на цитокини, получени от моноцити (използван тук като изчисление на обучен имунитет) варира между отделните индивиди, с неподдържан анализ на клъстера на увеличеното производство на цитокини 1 месец след ваксинацията с БЦЖ ясно показва струпване на вродени цитокини и втори клъстер на Т-помощник 1 / Th17 лимфоцитни цитокини. В рамките на вродения цитокинен клъстер индуцирането на IL-1β и IL-6 продукцията е силно свързано (Фигура 2С).
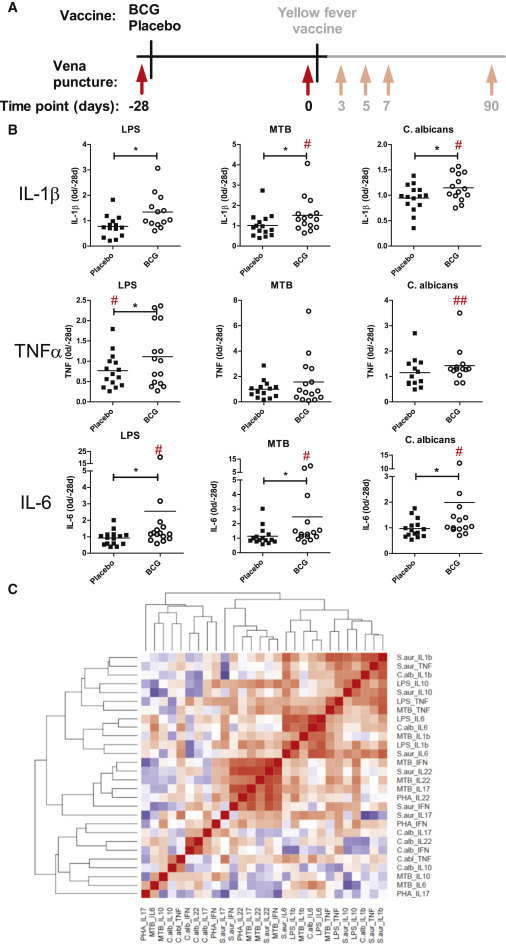
Фигура 2: BCG предизвиква трениран имунитет In vivo
БЦЖ ваксинацията намалява виремията при жълта треска
За да се разгледа клиничната значимост на наблюдаваните епигенетични и функционални ефекти на BCG, се използва атенюирания жив YFV като модел за вирусна инфекция при хора. YFV виремия, определена чрез RT-PCR, достига своя максимум на 5-ия ден след ваксинацията, както беше съобщено по-рано от други (Edupuganti et al., 2013) (фигури 3А, 3В и S3B). Субекти, които са били ваксинирани с БЦЖ 1 месец преди ваксинация срещу жълта треска, показват значително по-ниска виремия в сравнение със субекти, които са получили плацебо ваксинация (Фигура 3В, по-високи стойности на КТ, следователно по-ниска виремия, за доброволци, ваксинирани с БЦЖ). По-ниските концентрации на вируса в циркулиращи БЦЖ доброволци също се отразяват от по-ниската концентрация на циркулиращи цитокини (Фигура 3С). Циркулиращите концентрации на IL-1β преди и след ваксинацията са под границата на откриване. Важното е, че когато се измерват антителата, неутрализиращи жълтата треска, на 3 месеца след ваксинацията, не са открити значителни разлики между двете групи (Фигура 3D), което предполага, че ваксинацията с БЦЖ има незначително въздействие върху хуморалните отговори на ваксинацията срещу жълта треска, въпреки намалената виремия , В допълнение, BCG ваксинацията не промени специфичния клетъчен отговор на YFV, измерен чрез продукцията на IFNγ от PBMC (Фигура S3C).
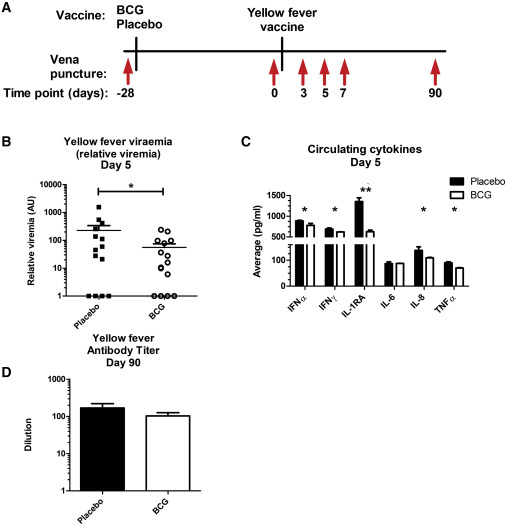
Фигура 3: BCG ваксинацията понижава виремията срещу жълта треска
Неспецифичното увеличение на производството на IL-1β след ваксинацията с БЦЖ е корелация на защитата срещу виремия от жълта треска
След това се установи дали индуцирането на ex vivo цитокинните реакции, свързани с трениран имунитет, както бе отбелязано по-рано, корелира с виремията на жълтата треска. Повишаването след ваксинацията при производството на TNFα и IL-6 не корелира с виремията (фигури 4А и S4A). За разлика от това, увеличеният производствен капацитет на IL-1β след ваксинация с БЦЖ силно прогнозира по-ниска виремия след последваща инфекция с жълта треска (фигури 4А и 4В). Сред другите цитокини индуцирането на IL-10 при стимулация с Candida albicans също показва отрицателна корелация с виремия (фигури 4А, 4В и S4A). Интересното е, че виремията не корелира с индуцирането на специфични клетъчни отговори на YFV от BCG, измерена чрез продукцията на IFNγ от PBMC (фигури 4С и S4B). В допълнение, не е открита корелация между виремия и концентрации на Th17 цитокините IL-17 и IL-22 (Фигура S4A). Това е забележително, тъй като се наблюдава индукция на CD8 + и полифункционални CD4 + отговори след БЦЖ ваксинация (Фигура S2) (Boer et al., 2015, Kleinnijenhuis et al., 2012). Концентрациите на титри на антитяло, неутрализиращи жълта треска, също не корелират с индуцирането на цитокини (нито вродени, нито адаптивни) (Фигура 4D).
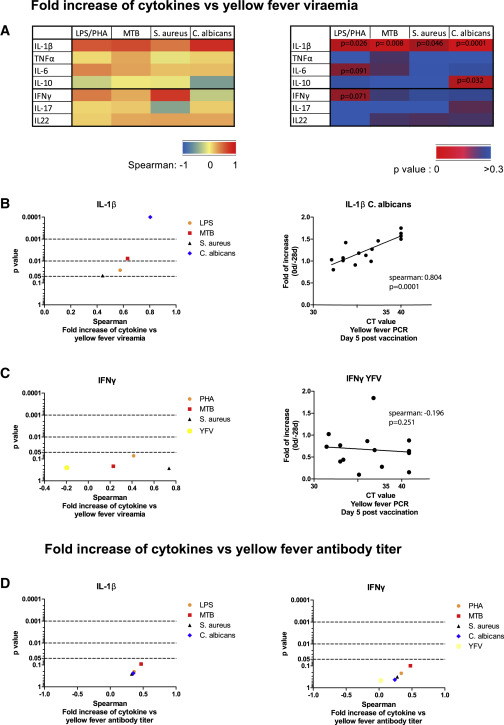
Фигура 4: Въвеждането на IL-1β отрицателно корелира с виремията на жълтата треска
Епигенетичните разлики влияят на виремията при жълтата треска
Освен корелацията с цитокиновата индукция, се определя и корелация на епигенетичните промени, предизвикани от BCG и виремията на жълтата треска. За да направят това, доброволците, представени на Фигура 1, са разделени на група от отговорили на BCG ваксинация (R, максимална виремия с жълта треска CT> 36) и нереагиращи (NR, CT <36). Предшестващите H3K27аc епигенетични разлики (в началната линия, преди BCG ваксинация) на ниво на генния регион са определени между R и NR, като установяват важни разлики между тези две групи доброволци, което подсказва за пътищата, важни за отговора след ваксинацията. Интересното е, че най-високо класираният геномен регион в този анализ е 7,6 kb нагоре от кода на гена за NOD2 (FC = 6,3, коригирана p стойност = 2,42 Ч 10–8), вродения имунен рецептор, разпознаващ мурамил дипептид: по-ранно проучване показва, че моноцити, изолирани от индивиди с NOD2 мутации, водещи до дефектен рецептор, не могат да бъдат обучени in vitro с BCG (Arts et al., 2015, Kleinnijenhuis et al., 2012) (фигури 5А и 5В).
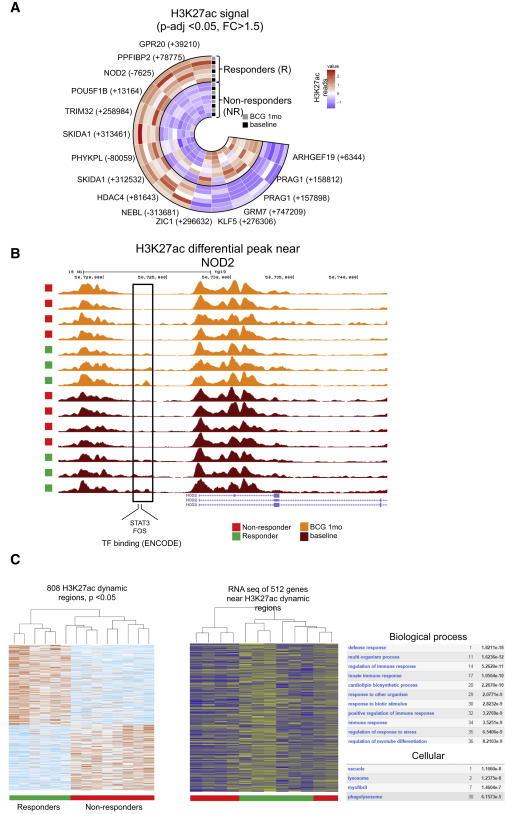
Фигура 5: H3K27ac целогеномен анализ на моноцити между респонденти и неотговарящи
Освен това, анализът на пътя на профилите на H3K27ac между R и NR разкрива няколко интересни резултата. Още веднъж, анализът на
RNAseq не показва ясен модел, както се очаква, тъй като клетките не са стимулирани повторно преди анализа (Фигура 5С). Сред основните диференцирано регулирани пътища на ниво епигенетична (но не и РНК) са „латентна инфекция с туберкулоза“, която е в съответствие с ваксинацията с BCG, както и общи имунологични пътища като „Имунен отговор“ и „Отговор на цитокин стимулант“ (Фигура S5A), показващи епигенетичните корелати на защита до виремията на жълтата треска.
БЦЖ: Генетични полиморфизми в гени на IL-1β модулират трениран имунитетен отговор
Ролята на IL-1β като трениран имунитетен корелат за защита срещу виремия на жълта треска се подкрепя от допълнителни генетични и имунологични валидиращи проучвания. Първо, изследва се ефекта на генетичните промени в IL1B върху индуцираните от БЦЖ цитокинни отговори на обучен имунитет в 200FG групата на здрави доброволци (Li et al., 2016). Поразително е, че цитокиновите отговори, показващи обучения имунитет, индуцирани от БЦЖ, са модулирани от известен полиморфизъм, разположен в промоторната област на гена, кодиращ IL-1β (IL1B; rs16944) (Фигура 6А). Наличието на две копия на алела А на rs16944 е свързано със значително нарушено производство на цитокини, свързано с тренирани реакции на имунитет. Интересното е, че in vitro проучванията показват, че IL1B rs16944 алелът е свързан с намалена продукция на IL-1β (Wen et al., 2006, Wуjtowicz et al., 2015). В съответствие с тези открития, се демонстрира намалена експресия на тРНК на IL-1β при индивиди с генотип на АА в сравнение с индивиди, наследили генотип на GG (Фигура S5B). Като допълнителна подкрепа за ролята на IL-1β в индуцирания от БЦЖ трениран имунитет, полиморфизмите в няколко допълнителни гена от семейството на IL-1, кодиращи IL-1 и IL-18 рецептори, както и възпалителния компонент PYCARD / ASC, показват силно въздействие за индуцирането на цитокини, свързани с трениран имунитет (Фигура 6В). За разлика от това, полиморфизмите в гена, кодиращ TNFα, не модулират in vitro обучени имунитетни отговори и само за един полиморфизъм в IL6 е установено, че слабо повлиява тренировката (данните не са показани).
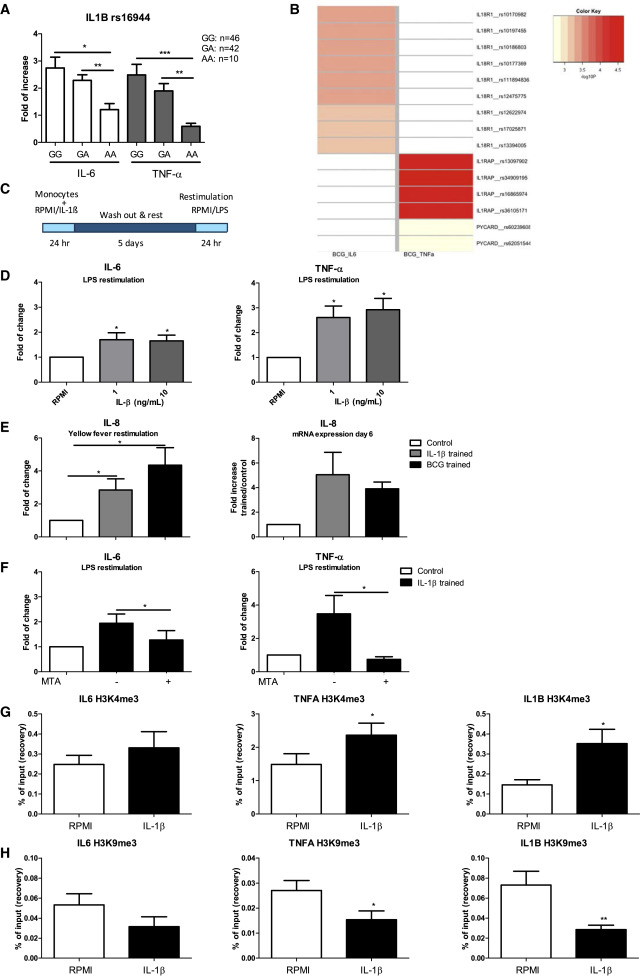
Фигура 6: Ролята на IL-1β за тренирания имунитет
Епигенетичните промени медиират обучения на IL-1β трениран имунитет
За да се получи допълнителна представа за ролята на IL-1β в медиирането на тренираните имунитетни реакции, следва да се прецени дали IL-1β сам може да индуцира трениран имунитет in vitro. Използвайки описания по-рано модел in vitro на трениран имунитет (Bekkering et al., 2016, Kleinnijenhuis et al., 2012), грундиране на моноцити с IL-1β (1-10 ng / mL) за 24 часа (Фигура 6С) на провъзпалителните цитокини IL-6 и TNFa при LPS рестимулация на 6-ия ден (Фигура 6D). Наблюдава се също подобрено производство на IL-8 от моноцити, които са обучени с IL-1β или БЦЖ и са рестимулирани с YFV. Анализът на експресията на тРНК на IL-8 показва засилена регулация на IL-8 както в моноцитите, обучени с BCG, така и в IL-1β, в сравнение с контрола (Фигура 6Е). Рестимулацията с YFV на 6-ия ден не води до IL-6 или TNFa продукция (данните не са показани). Предварителното лечение с хистон метилтрансфераза инхибитор MTA (5'-дезокси-5'-метилтио-аденозин) отменя IL-1β-индуцирания трениран имунитет отговор, което предполага, че in vitro тренировъчният ефект на IL-1β се медиира чрез епигенетично препрограмиране на моноцити (Фигура 6F). Това е потвърдено от IL-1β-медиирано индуциране на епигенетични промени 6 дни след IL-1β лечение в промоторни региони на TNFA, IL6 и IL1B, с повишено триметилиране на лизин 4 в хистон 3 (H3K4me3; Фигура 6G), маркер на увеличена генна транскрипция и намалено триметилиране на лизин 9 при хистон 3 (H3K9me3; Фигура 6Н), репресивен белег. Увеличаването на H3K4me3 и намаляването на H3K9me3, индуцирано от IL-1β, беше най-силно изразено при промотора на IL1B.
ИЗВОДИ ОТ БЦЖ ПРОУЧВАНИЯТА
Последните проучвания показват, че функционалната адаптация на вродените имунни клетки след инфекция или ваксинация, която се предизвиква чрез епигенетично препрограмиране, е отговорна за фактически вродена имунна памет, наричана още трениран имунитет (Netea et al., 2016). Известно е, че ваксинацията с BCG отдавна е придружена от по-ниска смъртност при ваксинирани деца, ефект, който не може да се припише напълно за защита срещу туберкулоза, но това вероятно се дължи на защита срещу неонатален сепсис и инфекции на дихателните пътища. Въпреки че е съобщено, че тази хетероложна защита се дължи поне отчасти на индуциране на трениран имунитет (Kleinnijenhuis et al., 2012), досега не е направена цялостна оценка на епигенетичните програми, предизвикани от БЦЖ. Също така са налице доказателства за защитни ефекти на трниран имунитет, предизвикан от BCG, върху несвързани инфекции при хора.
В това проучване сеописват епигенетичните промени, предизвикани в мащаб на генома от БЦЖ в човешки моноцити. Избрано е да се проучи H3K27ac хистонния знак, тъй като той е свързан с "активно" състояние на хроматин както при генни промотори, така и към подобрители. Освен това преди това се показа силна зависимост между промените на H3K27ac и H3K4me3 по време на трениран имунитет, като H3K27ac е най-динамичният белег (Saeed et al., 2014). Сред гените, показващи повишен H3K27ac, се идентифицира обогатяване в гени, кодиращи протеини, участващи в клетъчната сигнализация, както и възпаление: цитокини и хемокини, EGFR и VEGF пътища. В допълнение, пътят на PI3K / AKT също е показан като регулиран и това се подкрепя от последните проучвания, демонстриращи участието му в индуцирането на трениран имунитет от БЦЖ и β-глюкан (Arts et al., 2016, Cheng et al. ., 2014). Епигенетичният профил, предизвикан от БЦЖ, показва близки сходства с тренирания имунитет, индуциран от β-глюкан in vitro (Saeed et al., 2014), което предполага, че има ядрен трениран отговор на имунитета, предизвикан от различни стимули.
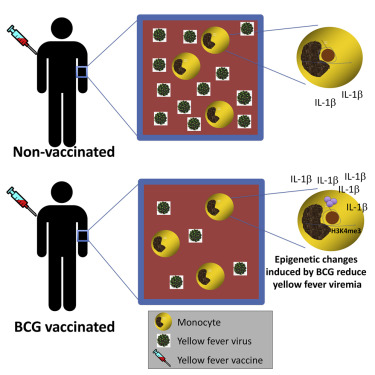
Епигенетичното препрограмиране на моноцити, предизвикано от БЦЖ ваксинация, е придружено от значително променени отговори на вродени имунни клетки. Този процес тук е ясно илюстриран от по-високото възпалително производство на цитокини (TNFa, IL-1β, IL-6) на PBMC от доброволци, ваксинирани с БЦЖ, в сравнение с лекуваните с плацебо лица. В този случай е избрано стимулиране на PBMC (и не силно пречистени моноцити), за да се имитира възможно най-близо клиничната ситуация in vivo. В допълнение, докато епигенетичните промени, наблюдавани при силно пречистените моноцити, са показателни за предизвикването на обучени имунитетни програми чрез BCG ваксинация, функционалните последици, измерени в PBMC, могат също да бъдат повлияни от наличието на лимфоцити. Разликите в производството на цитокини след БЦЖ ваксинация са наблюдавани в по-ранни проучвания както при деца (Jensen et al., 2015), така и при възрастни (Kleinnijenhuis et al., 2012). Амплитудата на реакциите на цитокини, показващи индуцирането на трниран имунитет в настоящото проучване, е малко по-слабо изразена в сравнение с предишни проучвания, вероятно поради разликите в партидите на BCG (Biering-Sorensen et al., 2015).
Несъмнено демонстрирането на корелация между индуцирането на обучен имунитет и защитата срещу контролирана инфекция при хората е откроена. Доказателството за принципа на изследване показва, че БЦЖ ваксинацията предпазва от последваща, несвързана вирусна инфекция в контролиран от човека модел на YFV инфекция. Този модел има предимството в използването на жив вирус, който няма вредни ефекти върху гостоприемника и който може да бъде количествено наблюдаван чрез PCR. Демонстрацията на значително по-нисък пик на виремия при ваксинирани с БЦЖ индивиди в сравнение с хора, инжектирани с плацебо, ясно показва способността на БЦЖ да защитава от не-свързани инфекции при хора. Долната виремия също е придружена от по-ниско циркулиращи възпалителни медиатори при ваксинирани с БЦЖ индивиди. Този резултат се очаква, тъй като високият капацитет за производство на цитокини след ваксинация с БЦЖ ще доведе до бърз локален антимикробен отговор и последващо елиминиране на патогена, като по този начин ще предотврати системна реакция и високи нива на циркулиращи цитокини (Netea et al., 2003, van der Poll et al., 2017). Важно е, че въпреки по-ниското натоварване на вируса, БЦЖ ваксинацията не повлиява генерирането на защитни антитела срещу жълта треска и не повлиява специфичния ефект на YFV. Това предполага, че БЦЖ може да подобри антиген-представящия капацитет и адаптивните отговори, в съответствие с проучване, показващо благоприятни ефекти върху отговора на противогрипната ваксина (Leentjens et al., 2015). Наблюдаваните ефекти, които са показателни за индуциране на обучен имунитет, са клинично много релевантни, тъй като епидемиологичните проучвания показват, че БЦЖ ваксинирането води до по-ниска смъртност през целия месец след раждането (Aaby et al., 2011, Roth et al., 2004 ). Въпреки това са оправдани дългосрочните изследвания с по-широк анализ на функцията на моноцитите, за да се определи продължителността на ефекта на БЦЖ .
Важното е, че значителни разлики в епигенетичните маркери са очевидни при моноцитите от БЦЖ респонденти (с ниска виремия с жълта треска) и BCG, които не са отговорили (с по-висока виремия). H3K27ac на нивото на NOD2 рецептора (което е от съществено значение за индуцирането на трениран имунитет, индуциран от БЦЖ [Kleinnijenhuis et al., 2012]) корелира най-добре с отговора на BCG. Допълнителни имунни пътища, свързани с производството на цитокини и вродени имунни отговори, са показани от значение.
Едно от най-забележителните наблюдения е направено при изследване на корелатите на защита срещу виремия. По-рано се предполагало, че развитието на белег след ваксинация с БЦЖ може да се използва като маркер за неспецифични ефекти и детска преживяемост (Garly et al., 2003, Roth et al., 2005). Въпреки това, всички доброволци, ваксинирани с БЦЖ, развиват белег със съпоставим размер (0,5–0,7 cm) и не се наблюдава връзка между това и защитата. В допълнение, сгъваемата промяна на хетероложните Т клетъчни отговори (IFNγ, IL-17 и IL-22 продукция) след BCG ваксинация не показва никаква връзка с YFV виремия. За разлика от това, увеличаването на продукцията на IL-1β след БЦЖ силно корелира с по-ниска виремия след прилагане на YFV, докато производството на други производни на моноцити цитокини показва по-малка корелация. Това предполага, че индуцирането на IL-1β продукция, стимулирано от несвързани патогени, което е индикатор за обучени реакции на имунитет, а не адаптивни клетъчни отговори, както се оценява от производството на IFNγ, индуцирано от специфични стимули, е отговорно за защитата, предизвикана от БЦЖ срещу вирусна инфекция.
Фактът, че увеличаването на способността на вродените имунни клетки да освобождават IL-1β е по-силният корелат на защитата предполага, че този цитокин е решаващ компонент на тренирания имунитет. Тази констатация е изключително уместна поради директния защитен ефект на по-високи нива на IL-1β при вирусни инфекции (Azuma et al., 1992, Iida et al., 1989, Sergerie et al., 2007), въпреки че са възможни и други механизми. Ролята на IL-1β се подкрепя от допълнителни генетични и имунологични изследвания. Изучавайки ин витро обучение на моноцити, индуцирани от БЦЖ в клетки, изолирани от здрави доброволци от 200FG кохорта (Li et al., 2016), се демонстрира, че генетичните полиморфизми в гена, кодиращ IL-1β, но също така и други гени на IL -1 път като например възпалителния компонент ASC / PYCARD и гени, кодиращи IL-1 и IL-18 рецепторите, са свързани с величината на индивидуалния обучен имунитетен отговор, предизвикан от BCG. В последващи експерименти се установява, че самият IL-1β може да индуцира трениран имунитет и че този ефект е придружен от епигенетични промени на нивото на метилиране на хистон (H3K4me3 и H3K9me3). Това може да обясни по-ранни проучвания, които показват, че прилагането на една доза IL-1β на мишки преди инфекция може да защити срещу смъртоносен бактериален и гъбичен сепсис (van der Meer et al., 1988). В допълнение, за IL-1β е известно, че оказва силно въздействие върху миелопоезата (Dinarello, 2002) и може да се предположи, че IL-1β представлява ендогенен медиатор между периферното стимулиране на моноцитите и макрофагите чрез БЦЖ и дългосрочното функционално препрограмиране при нивото на костномозъчните потомци. Всъщност, придружаващи проучвания на Международния обучен имунитет консорциум (INTRIM) показват, че ефектите на нивото на миелоидните клетъчни прогенитори са от решаващо значение за индуциране на тренирания имунитет от β-глюкан (Mitroulis et al., 2018), BCG (Kaufmann et al., 2018) и диетата от западен тип (Christ et al., 2018) и идентифицират IL-1β и възпалителния път като ключови медиатори на този процес (Mitroulis et al., 2018, Christ et al. , 2018). Mitroulis et al. показват, че адаптациите в хематопоетични стволови и прогениторни клетки (HSPC) са свързани с увеличаване на IL-1β (а не на други цитокини) в течността на костния мозък, докато инхибирането на IL-1β възпрепятства β-глюкан-зависимото разрастване на HSPC и ефектите върху миелоидните клетъчни прогенитори. По подобен начин се показва, че диетата от западния тип е в състояние да индуцира обучен имунитет при мишки и IL-1 играе важна роля в този ефект. По този начин диетата от западния тип не предизвиква обучен имунитет и миелоидно прогениторно препрограмиране при нокаутирани мишки NLRP3, които имат дефекти при обработката на IL-1β. По подобен начин генетичният анализ разкри, че полиморфизмите в NLRP3 влияят на обучения от oxLDL обучен имунитет в човешките клетки.
Тъй като дисрегулираната продукция на IL-1β играе основна роля в етиологията на много автовъзпалителни заболявания, способността на IL-1β да индуцира трениран имунитет може да представлява централно събитие в патофизиологията на тези нарушения. Това се нуждае от допълнително изследване, тъй като може да представлява терапевтична цел за тези заболявания. Всъщност придружаващото изследване на Bekkering et al. на консорциума INTRIM показва дисрегулиран фенотип на трениран имунитет в моноцити, изолирани от пациенти с хипер IgD синдром (Bekkering et al., 2018), добре известен автовъзпалителен синдром.
Заключение: БЦЖ ваксината и обученият имунитет
В заключение, в едно от последните изследвания се отчита широката епигенетична програма, предизвикана от БЦЖ ваксинация при хора, което води до повишено активиране на циркулиращите моноцити. Освен това се доказва, че БЦЖ ваксинацията може да защити срещу несвързана вирусна инфекция в експериментален модел на инфекция при хора и се съобщава, че медикаментозните реакции на IL-1β, които са показателни за предизвикване на обучен имунитет, са най-надеждният корелат на това защита. Допълнителните генетични и имунологични валидиращи проучвания показват, че пътят на IL-1 е от решаващо значение за ефикасното предизвикване на обучен имунитет при хората и това може да има важно значение както за ваксинацията, така и за патофизиологията на автовъзпалителните заболявания.
Свързани статии:
Автор: Мартин Стефанов
Редактор: Григор Ангелов
Тags:
бцж ваксина, придобит имунитет, трениран имунитет, бцж и коронавирус, имунизация, бцж
Дата: 08 Юли 2020

















Остави мнение/коментар